Publicado: 14/04/21 13:40 Categorías: Biología molecular
El mieloma múltiple (MM) es un tipo prevalente de cáncer en la sangre y representa más de un 10% de todos los cánceres hematológicos.
Una de sus principales complicaciones es que afecta a los huesos, pudiendo provocar osteoporosis, lesiones líticas (destrucción de un área del hueso) y fracturas. Hasta un 80% de los pacientes con MM cursan con este tipo de problemas, viéndose enormemente afectada su calidad de vida. Debido a la naturaleza incurable de este tipo de lesiones, es necesario identificar nuevas dianas terapéuticas que no solo estén dirigidas a reducir la progresión tumoral sino también a revertir las lesiones óseas asociadas.
En la actualidad, las únicas estrategias que han sido aprobadas para tratar de revertir las lesiones óseas en el MM van dirigidas a inhibir o destruir los osteoclastos, que tienen una mayor actividad en MM y son responsables de la destrucción del hueso.
Una posible diana celular alternativa serían las células mesenquimales estromales (MSCs), las cuales son progenitoras de los osteoblastos (forman el hueso) y, por tanto, están implicadas en procesos de remodelación ósea. En MM se produce un deterioro en la diferenciación y función de los osteoblastos a partir de precursores mesenquimales, produciéndose, por tanto, la destrucción del hueso. En muchos pacientes con MM estas lesiones óseas permanecen incluso después de que haya remisión terapéutica, lo cual sugiere que se produce un defecto en las MSCs a largo plazo que bloquea su capacidad para diferenciarse a osteoblastos funcionales de la manera adecuada.
Además de su papel precursor de osteoblastos, las MSCs de la médula ósea juegan un papel fundamental en el apoyo a la progresión del mieloma y la resistencia a los medicamentos. También se sabe que las alteraciones en las MSCs son el resultado de su interacción con las células plasmáticas cancerosas, lo que las convierte en una diana interesante para tratar la enfermedad ósea del mieloma.
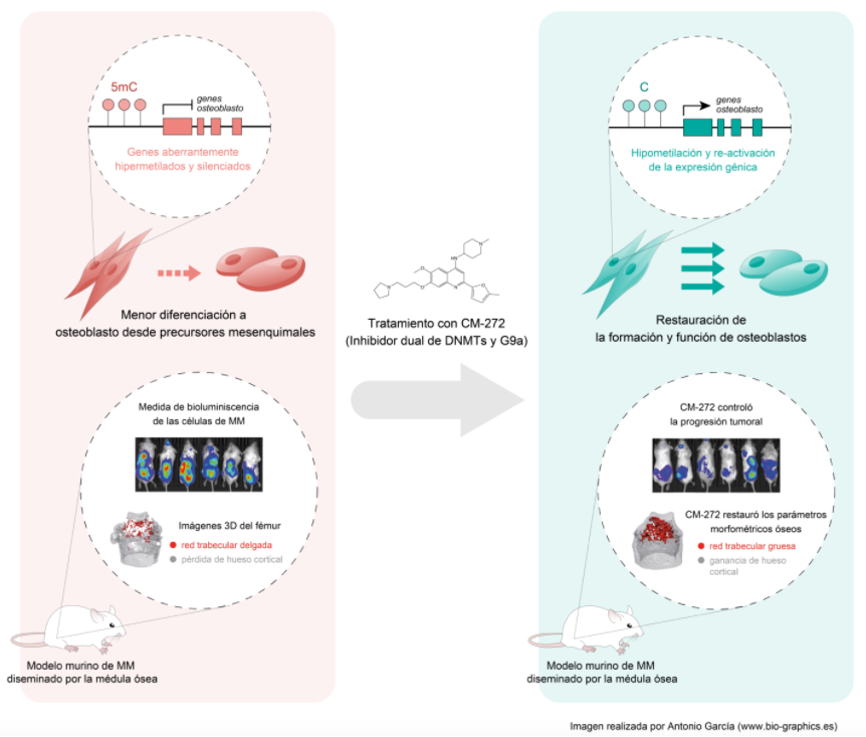
Una investigación conjunta del grupo de epigenética del Instituto de Investigación contra la Leucemia Josep Carreras y el IBMCC de Salamanca, describe por primera vez alteraciones epigenéticas en las MSCs de pacientes en diferentes etapas durante la progresión hacia mieloma múltiple. Las alteraciones descubiertas se dieron, principalmente, en los patrones de metilación del DNA y fueron identificadas en regiones relacionadas con genes (como son HOX, RUNX2, SPP1 o IBSP) que controlan la correcta diferenciación de las MSCs a osteoblastos.
Es conocido que las alteraciones en la metilación del DNA suelen tener un impacto directo en la expresión de los genes a los que afecta y en este estudio se ha podido poner de manifiesto que las células de mieloma son capaces de influir en el perfil de metilación de las MSCs que, aunque no son propiamente cancerosas, se encuentran en el microentorno tumoral. En los últimos años se ha confirmado el papel fundamental que juega el microambiente tumoral como mediador de la progresión tumoral e inmunosupresión en varios tipos de cáncer. La interacción recíproca que ocurre entre las células no tumorales y las neoplásicas está mediada por el contacto directo célula-célula, factores solubles y exosomas, que dan como resultado patrones de expresión génica diferencial que son impulsados por mecanismos epigenéticos.
El estudio desarrollado por los grupos españoles partía de la premisa de que las alteraciones epigenéticas son farmacológicamente reversibles y tenía la intención de comprobar si revertiendo las alteraciones de la metilación del DNA en las MSCs de mieloma se podría restaurar el fenotipo a osteoblastos sanos. Para ello, utilizaron la molécula CM-272 que tiene la capacidad de inhibir tanto a las DNA metiltransferasas (DNMTs) como a la histona metiltransferasa G9a.
Se pudo observar que el tratamiento de MSCs de pacientes con mieloma múltiple, utilizando esta molécula CM-272, lograba revertir su fenotipo aberrante y ayudaba a la correcta diferenciación de las MSCs a osteoblastos formadores de hueso. Fue un resultado directo de la reversión de la metilación del DNA aberrante en las células afectadas, por la acción de la molécula inhibidora. Además, el tratamiento con CM-272 logró reducir tanto la carga tumoral como mejorar la pérdida ósea asociada al MM en un modelo de ratón con MM diseminado en la médula ósea.
Asimismo, otro reciente trabajo ha demostrado que la reducción simultánea de DNMT1 y G9a estimula la expresión osteogénica y la mineralización de la matriz ósea en un modelo de rata en el que se estudiaba la pérdida ósea en condiciones de ingravidez.
Por tanto, este estudio pone encima de la mesa el gran potencial que existe para corregir las alteraciones epigenéticas en pacientes con MM y, de esta manera, tratar la enfermedad ósea asociada a esta enfermedad.
En Condalab contamos con una marca de referencia en el campo de la epigenética, Active Motif, para poder aportar todas las soluciones que necesitas para llevar a cabo estudios de metilación del DNA.
Si necesitas más información sobre qué productos podemos ofrecerte ponte en contacto con nosotros a través de este formulario.
Bibliografía:

 Probióticos: ¿Cuál es el bueno?
Probióticos: ¿Cuál es el bueno?
 Virus recombinantes en investigación y bioproducción: retos y soluciones
Virus recombinantes en investigación y bioproducción: retos y soluciones
 Condalab dice SÍ a la feria líder en tecnologías del laboratorio: Analytica 2026
Condalab dice SÍ a la feria líder en tecnologías del laboratorio: Analytica 2026
 CONDALAB estará presente en WHX Labs Dubai 2026
CONDALAB estará presente en WHX Labs Dubai 2026
 Condalab y BD: una colaboración que impulsa las ómicas espaciales
Condalab y BD: una colaboración que impulsa las ómicas espaciales