Publicado: 18/12/19 12:45 Categorías: Biología celular
En España ya conviven los CAR-T académicos y comerciales
Los cánceres en las células sanguíneas son conocidos como cánceres hematológicos y suponen entre un 8-10% de todos los tumores. Algunos ejemplos son el linfoma, el mieloma o la leucemia y cada año se diagnostican en Europa casi 200.000 nuevos casos, con una mortalidad de casi el 50%. Normalmente, se tratan con quimioterapia más trasplante de médula ósea; pero desde hace un tiempo está cobrando cada vez más fuerza el tratamiento con CAR-T (células T con receptores de antígenos quiméricos) que unifica 3 tipos de terapia avanzada: la terapia celular, la inmunoterapia y la terapia génica. Se habla de terapia génica, porque se modifican genéticamente los linfocitos para combatir la enfermedad; terapia celular, porque son estas mismas células modificadas las que se infunden en el paciente para tratarlo e inmunoterapia, porque las células del sistema inmunitario serán las encargadas de luchar contra las células cancerígenas.
Las leucemias y linfomas que se producen por alteración de los linfocitos B tienen algo en común y es que expresan en su superficie una proteína (antígeno) conocido como CD-19. Al producirse el cáncer, los linfocitos T no son capaces de reconocer este antígeno y, por tanto, no pueden frenar la replicación de las células cancerosas. La terapia CAR-T surgió precisamente como una herramienta para facilitar a los linfocitos T reconocer y destruir las células tumorales y consiste en extraer los linfocitos T del paciente, modificarlos genéticamente para que expresen en su superficie el receptor CAR-T (que reconocerá CD-19) e introducirlas de nuevos en el paciente para destruir las células malignas.
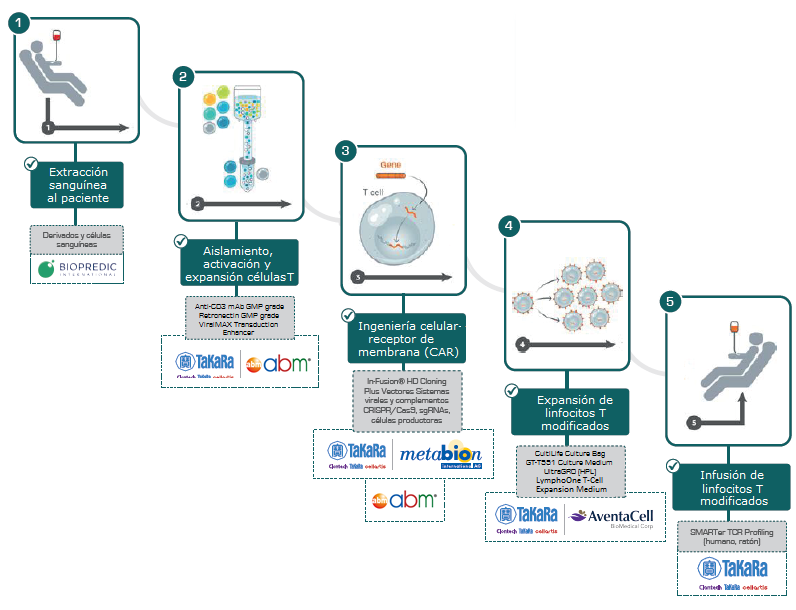
Hasta el momento, existen dos tratamientos, KymriahTM (Novartis) y YescartaTM (Gilead), basados en células CAR-T que están aprobados por la Agencia Americana (FDA) y Europea del Medicamento (EMA) para su uso clínico y que han demostrado ser eficaces y seguros frente a determinados tipos de cánceres. Están indicados para neoplasias CD19 positivas y con resultados muy prometedores, en los que el 80% de los pacientes están libres de la enfermedad tras un año del tratamiento.
Hasta mitad del 2018, los tratamientos CAR-T anteriores solo han estado disponibles para enfermos a través de ensayos clínicos, pero dado el coste de los tratamientos, algunos grupos de hematólogos e inmunólogos han decidido empezar a trabajar en los llamados “CAR-T académicos”, impulsados por instituciones públicas y con un coste más asequibles. En este sentido, investigadores de la Paz, acaban de publicar en “Frontiers in Immunology” un paper con un trabajo multidisciplinar en el que muestran el procedimiento de fabricación de células CAR-T (expresando el receptor NKG2D) a nivel hospitalario para su aplicación clínica.
En la actualidad, conviven en España los tratamientos CAR-T comerciales y académicos y en abril de este mismo año el Ministerio sacó la lista completa de todos los centros españoles que tienen autorización para administrar este tipo de terapias CAR-T y que incluyen hospitales públicos de las principales ciudades españolas (Madrid, Barcelona, Sevilla, Valencia y Salamanca), entre los cuales está el Hospital Clínic de Barcelona, Hospital Santa Creu i Sant Pau, Hospital Gregorio Marañón, Hospital La Fe, Complejo Asistencial de Salamanca, H. Virgen del Rocío, H. Clínico de Valencia, H. Dr. Negrín de Canarias, Hospital Vall d’Hebrón, H. Niño Jesús y Sant Joan de Déu (estos tres últimos además para niños).
Aunque todavía queda mucho por investigar en cuanto a efectos secundarios, eficacia respecto a tratamiento de entrada actual, desarrollo de métodos más rápidos de producción, nuevos CAR-T frente a antígenos diferentes a CD19… no nos cabe la menor duda de que este tipo de terapia supone un avance enorme en la lucha contra el cáncer.
Si quieres sabes más acerca de los productos de nuestro portfolio relacionados con CAR-T, puedes echar un vistazo a nuestra sección dedicada a “Terapia Génica y Celular”; pero si has leído hasta aquí es que realmente te interesa esta temática o estás trabajando en un proyecto relacionado. Llegado a este punto, ¿por qué no ampliar información a través de esta webinar?
Si necesitas además que te ayudemos a poner a punto tu proyecto, no dudes en contactarnos para concertar una cita con nuestros expertos y poder darte asesoramiento especializado.
Referencias:
Fernández L, Fernández A, Mirones I, et al. GMP-Compliant Manufacturing of NKG2D CAR Memory T Cells Using CliniMACS Prodigy. Front Immunol. 2019;10:2361. Published 2019 Oct 10. doi:10.3389/fimmu.2019.02361

 CONDALAB estará presente en WHX Labs Dubai 2026
CONDALAB estará presente en WHX Labs Dubai 2026
 Condalab y BD: una colaboración que impulsa las ómicas espaciales
Condalab y BD: una colaboración que impulsa las ómicas espaciales
 Fraude alimentario: ¿Cómo lo detectamos?
Fraude alimentario: ¿Cómo lo detectamos?
 Visítanos en MEDICA 2025: descubre nuestras soluciones de detección precisa.
Visítanos en MEDICA 2025: descubre nuestras soluciones de detección precisa.
 Condalab refuerza su presencia en dos congresos clave
Condalab refuerza su presencia en dos congresos clave