Publicado: 15/09/21 17:12 Categorías: Biología molecular
Una de las áreas de estudio que más auge está experimentando durante los últimos años es, sin duda, la terapia génica y celular.
De forma resumida, puede decirse que la terapia génica consiste en la transferencia o modificación de uno o varios genes con el fin de combatir una determinada enfermedad haciendo uso, para ello, de distintas herramientas tanto a nivel molecular como celular.
Uno de los principales retos que plantea este tipo de terapia es que, para que sea efectiva, debe llegar al órgano diana en un número lo suficientemente alto como para poder ejercer su efecto terapéutico.
A este respecto, investigadores de la Universidad de Oregón y del Instituto Científico San Rafael de Milán han desarrollado una nueva estrategia que permite mejorar la eficacia de la terapia génica dirigida al hígado, al incrementar la biodisponibilidad de la misma en dicho órgano.
Los estudios se han llevado a cabo en modelos de ratón para enfermedades tales como la hemofilia B y la fenilcetonuria, ambas causadas por alteraciones genéticas en genes que se expresan principalmente en el hígado.
- La hemofilia B es un trastorno hemorrágico hereditario de carácter recesivo causado por la falta o disminución del factor IX de coagulación sanguínea, una proteína implicada en la cascada de coagulación y que se sintetiza a nivel hepático.
- La fenilcetonuria es una enfermedad genética en la que se produce una gran acumulación del aminoácido fenilalanina en el organismo. Dicha acumulación está provocada por una mutación recesiva en el gen de la fenilalanina hidroxilasa, la enzima encargada de catalizar el primer paso del metabolismo de la fenilalanina en el hígado.
Los grupos implicados en esta investigación han empleado una terapia génica basada en el empleo de vectores lentivirales portadores de una copia sana del gen responsable de la enfermedad, F9 en la hemofilia B y PAH en la fenilcetonuria.
Con el fin de mejorar la eficacia de la terapia, se decidió incorporar al vector lentiviral no sólo la información genética de estos genes, sino también el material necesario para la producción de un RNA que proteja a las células de la toxicidad generada por dosis altas de paracetamol. Dicho RNA actúa bloqueando al cofactor Cypor, implicado en el metabolismo de este fármaco por el citocromo P450.
Una vez administrada la terapia a los modelos animales, a los ratones se les administraba una dosis tóxica de paracetamol, con el fin de seleccionar las células en las que sí se había integrado la información genética del vector lentiviral, las cuales no mostraban signos de toxicidad, y eran las únicas capaces de proliferar.
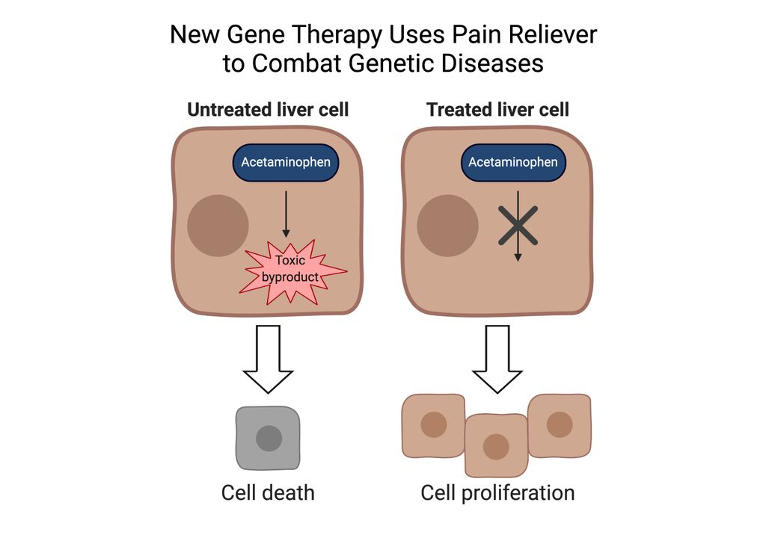
Los resultados obtenidos en estos estudios demostraron que las células modificadas fueron capaces de reemplazar hasta un 50% de masa hepática, consiguiendo que las copias sanas de los genes introducidos se produjesen a niveles terapéuticos.
De este modo, y en palabras del investigador principal, Markus Grompe, se está “envenenando a las células no tratadas con un exceso de paracetamol” cuya toxicidad es fácilmente controlable y no deja secuelas permanentes.
Una vez validados los resultados en modelos animales, el siguiente paso consistirá en probar estas terapias en primates no humanos y en modelos celulares humanos, como paso previo antes de poder iniciar un ensayo clínico con pacientes.
Puedes consultar los datos de este estudio en el siguiente enlace.
Si tú también trabajas en terapia génica y celular, no dudes en contactar con nosotros para descubrir todo lo que podemos ofrecerte.
Bibliografía:

 Probióticos: ¿Cuál es el bueno?
Probióticos: ¿Cuál es el bueno?
 Virus recombinantes en investigación y bioproducción: retos y soluciones
Virus recombinantes en investigación y bioproducción: retos y soluciones
 Condalab dice SÍ a la feria líder en tecnologías del laboratorio: Analytica 2026
Condalab dice SÍ a la feria líder en tecnologías del laboratorio: Analytica 2026
 CONDALAB estará presente en WHX Labs Dubai 2026
CONDALAB estará presente en WHX Labs Dubai 2026
 Condalab y BD: una colaboración que impulsa las ómicas espaciales
Condalab y BD: una colaboración que impulsa las ómicas espaciales