Publicado: 03/09/19 09:46 Categorías: Biología molecular
La tecnología CRISPR/Cas es una herramienta molecular que permite la edición del genoma de cualquier célula; para ello, aprovecha la capacidad que presentan ciertas proteínas para cortar el ADN permitiendo, de este modo, modificar su secuencia.
El descubrimiento de esta tecnología se remonta a los años 90, al investigar cómo ciertas bacterias eran capaces de defenderse de las infecciones víricas destruyendo el material genético exógeno. Sin embargo, no fue hasta el 2012 cuando se demostró cómo emplear este sistema inmune bacteriano como herramienta de edición génica controlada, capaz de dirigirse de forma específica a un gen concreto.
Pero ¿cómo funciona?
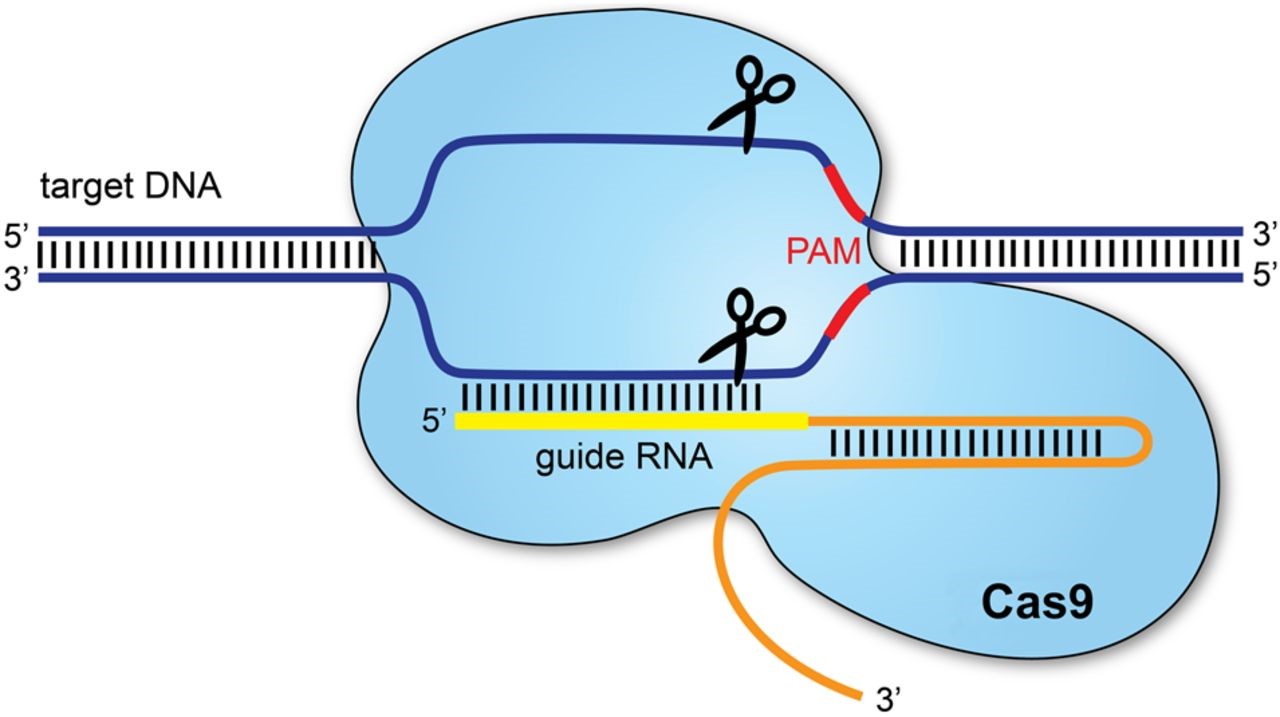
El mecanismo de actuación de CRISPR/Cas se basa en dos componentes principales: por un lado, una pequeña molécula de ARN, conocida como single-guide RNA, que será el encargado de dirigir a la Cas9 a la región concreta del genoma que se quiere modificar; y, por otro, la propia enzima, una proteína con actividad endonucleasa capaz de cortar específicamente el ADN.
Una vez que la nucleasa ejerce su función, se crea un gap o hueco en el genoma que debe ser reparado por alguna de las dos vías de las que dispone la célula: bien por recombinación no homóloga o bien por reparación dirigida por homología.
El primer tipo suele producir inserciones o deleciones aleatorias provocando, de este modo, el knockout del gen. Sin embargo, la reparación dirigida permite introducir secuencias específicas haciendo posible, de este modo, la corrección de secuencias mutadas en el genoma.
A este respecto, el pasado mes de agosto se inició el primer ensayo clínico a nivel mundial que emplea la tecnología CRISPR de forma directa en pacientes. El objetivo de dicho ensayo es la evaluación de la seguridad y la eficacia de este tipo de edición génica en el tratamiento de un tipo de ceguera hereditaria.
Se trata de la amaurosis congénita de Leber, una enfermedad que engloba distintos trastornos oculares de inicio temprano que afectan al desarrollo y a la funcionalidad de la retina, siendo la principal responsable de la ceguera infantil. Más del 70% de los casos están causados por mutaciones puntuales en genes implicados en el desarrollo de las células fotorreceptoras o en la percepción y transducción de la información visual, siendo las más habituales las que afectan al gen CEP290.
Esta será la primera vez que se emplee la técnica CRISPR de forma directa en pacientes pues, aunque sí que se han llevado a cabo ciertos tratamientos ex vivo, extrayendo células humanas, modificándolas en el laboratorio y re-inyectándolas, nunca se había aplicado directamente al cuerpo humano. Dado que el ojo es un órgano relativamente aislado del resto del organismo, se espera que esta aproximación facilite que el tratamiento sea específico, y con menor riesgo de que afecte a otras partes del cuerpo.
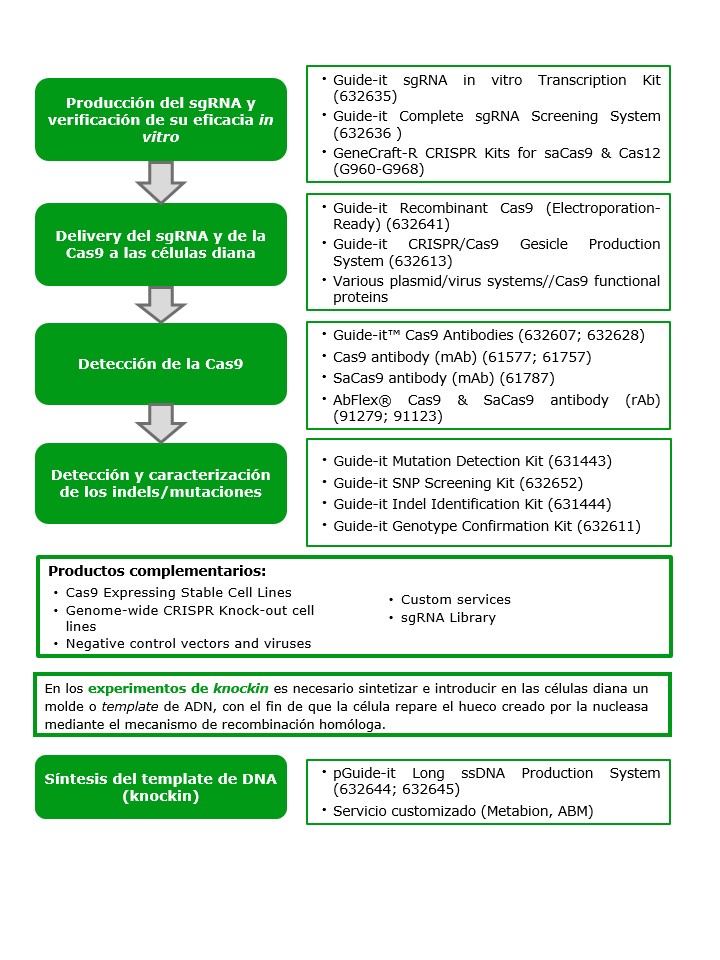
¿Y tú? ¿Trabajas con CRISPR? Descubre todo lo que Condalab puede ofrecerte para llevar a cabo tus experimentos de edición génica (tanto knockout como knockin) mediante esta revolucionaria herramienta.

 Probióticos: ¿Cuál es el bueno?
Probióticos: ¿Cuál es el bueno?
 Virus recombinantes en investigación y bioproducción: retos y soluciones
Virus recombinantes en investigación y bioproducción: retos y soluciones
 Condalab dice SÍ a la feria líder en tecnologías del laboratorio: Analytica 2026
Condalab dice SÍ a la feria líder en tecnologías del laboratorio: Analytica 2026
 CONDALAB estará presente en WHX Labs Dubai 2026
CONDALAB estará presente en WHX Labs Dubai 2026
 Condalab y BD: una colaboración que impulsa las ómicas espaciales
Condalab y BD: una colaboración que impulsa las ómicas espaciales