Publicado: 13/09/19 08:48 Categorías: Biología molecular
4 trucos para separar células únicas por citometría de flujo antes del análisis del transcriptoma
El obtener buenos resultados de RNA-seq a partir de células únicas, depende de la capacidad de capturar células individuales y de prevenir la degradación del RNA antes de la preparación de la librería. En este caso, el sorting resulta el punto más crítico y requiere de cierta experiencia, además de conocer determinados trucos a la hora de manejar el FACS. A continuación, te facilitamos un listado de consejos y recomendaciones para optimizar la calidad de la muestra:
1) No obstruyas el citómetro
Aunque parezca algo muy básico, elimina siempre posibles restos celulares por centrifugación, para tener una preparación de células lo más limpia posible. Además, ayuda mucho el hecho de utilizar una buena técnica de disociación celular, para maximizar el número de células individualizadas, sin comprometer su viabilidad. Nuestra recomendación es que elimines el magnesio y el calcio de la solución donde vayas a resuspender las células, utiliza simplemente PBS (1X filtrado y frío) suplementado con BSA al 1-2%. Utiliza además una tinción de viabilidad para capturas las células individuales vivas.
2) Trata las células suavemente
El FACS resulta un procedimiento duro para las células, pero puedes minimizar el daño y la lisis celular con las siguientes recomendaciones:
- Utiliza boquillas de gran tamaño y velocidades bajas
- Trabaja conjuntamente con la core facility de tu centro o el fabricante del instrumento para encontrar los settings adecuados para tu sorting.
3) Separa las células en el fondo del pocillo
Esto parece sencillo, pero resulta un problema bastante común. Lo ideal es que el citómetro de flujo esté equilibrado y deposite las gotitas que contienen las células en el fondo del pocillo, pero si no están alineados adecuadamente, las células pueden terminar en los lados del pocillo, donde podrán deshidratarse rápidamente, arriesgando la integridad del RNA o incluso no terminar en el pocillo. Echa un vistazo a las referencias si quieres saber más acerca de cómo otros investigadores han desarrollado métodos de control de calidad con beads fluorescentes (1) o reporters (2).
4) Utiliza un buffer de lisis
Tras el sorting, el transcriptoma debe estabilizarse lo más rápidamente posible. Por lo tanto, recomendamos emplear un tampón de lisis frío y recién preparado, conteniendo inhibidor de la RNasa y centrifugar suavemente a 100 g durante 15-30 segundos. Si no vas a realizar inmediatamente la síntesis del cDNA, coloca las muestras inmediatamente en hielo seco para congelarlas rápidamente y almacenarlas a -80ºC, incluso durante semanas. A continuación, encontrarás alguna recomendación acerca de la cantidad de buffer a añadir en función del kit de preparación de librerías que vayas a emplear:
Puedes ampliar información acerca del workflow completo para preparación de librerías a partir de células, en la siguiente imagen:
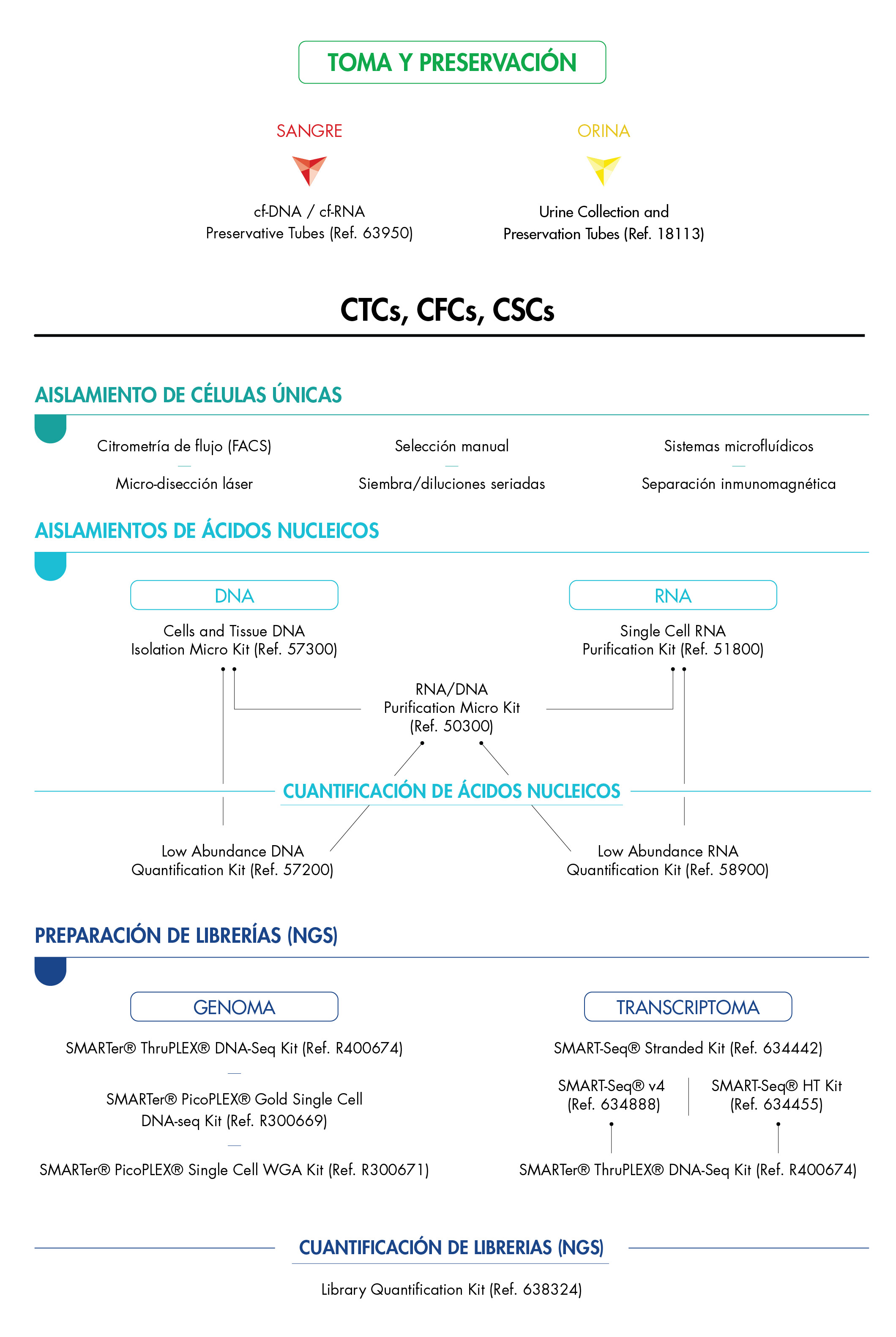
Referencias:
- Zigon, E. S. et al. A rapid single cell sorting verification method using plate-based. Cytom. Part A 93, 1060–1065 (2018).
- Rodrigues, O. R. & Monard, S. A rapid method to verify single-cell deposition setup for cell sorters. Cytom. Part A 89, 594–600 (2016).

 Probióticos: ¿Cuál es el bueno?
Probióticos: ¿Cuál es el bueno?
 Virus recombinantes en investigación y bioproducción: retos y soluciones
Virus recombinantes en investigación y bioproducción: retos y soluciones
 Condalab dice SÍ a la feria líder en tecnologías del laboratorio: Analytica 2026
Condalab dice SÍ a la feria líder en tecnologías del laboratorio: Analytica 2026
 CONDALAB estará presente en WHX Labs Dubai 2026
CONDALAB estará presente en WHX Labs Dubai 2026
 Condalab y BD: una colaboración que impulsa las ómicas espaciales
Condalab y BD: una colaboración que impulsa las ómicas espaciales